引言
化学交换饱和转移(Chemical Exchange Saturation Transfer,CEST)成像是一种新的磁共振成像(Magnetic Resonance Imaging,MRI)对比机制[1, 2],其不仅可以对极低浓度的化学基团进行单独成像,而且可用于检测基团所在环境(如酸碱度[3]、温度等)[4],因此非常适合分子成像研究[5].酰胺质子转移(Amide Proton Transfer,APT)[6]成像将酰胺基团质子(–NH)作为交换点位置(δ 3.5),是使用最为广泛的CEST成像的亚型.大量研究表明,APT成像可以很好地提示肿瘤、缺血性中风及神经退行性病变[7]等病理信息[8, 9].目前APT成像的应用研究主要集中于颅脑[10, 11],在其他部位尤其是腹部的应用很少[12-14].
APT成像在腹部的应用受到多方面因素的限制.首先,被试呼吸会带来严重的运动伪影,通常的解决方案是呼吸触发技术,即采用压力传感器或横隔膜导航回波监测被试呼吸运动,并进行实时触发CEST数据采集[15].其次,腹部脂肪也会产生影响,传统APT效应的量化依赖于非对称性分析,而脂肪会在非对称性磁化转移率(Magnetization Transfer Asymmetry,
目前,临床定量APT成像一般采用非对称性分析法,得到的对比度信息并非单纯的APT效应.脂质等化合物中的氢核普遍存在核奥氏增强(Nuclear Overhauser Enhancement,NOE)[20]效应,其分布于δ −2 ~ −5之间,因此通过非对称性分析法中得到的对比度其实是“APT-NOE”加权成像.在超高场仪器中可利用三点法来提取APT信号[21],即采取Z谱δ 2与δ 5的信号做平均,用它减去δ 3.5的信号从而得到成像对比度,但这个方法准确度较差,且在目前临床使用的3 T系统中效果不明显.通过洛伦兹拟合法提取纯CEST信号是近年来备受关注的一个方法[22],其通过对采集的Z谱进行洛伦兹拟合得到不同成分所产生的信号,该方法不仅可以获得不同交换点位置的CEST成像,还可以得到NOE成像和磁化强度转移(Magnetization Transfer,MT)成像.但是,洛伦兹拟合法引入了过多的理想化因素,而实际在非超高场情形下,信号在Z谱上的谱宽很宽且相互叠加,并且NOE交换区域的信号线形并非理想的洛伦兹线形[23, 24].另外,要获得精准的拟合需要更密集频率位置的信号采集,需要花费大量的时间,这在腹部临床APT成像中无疑不太现实.因此,高效准确分离APT效应和NOE效应对于CEST定量成像很有必要.
本文提出了一种基于神经网络拟合的CEST后处理方法,通过对每个像素采集得到的Z谱特征进行识别,不需要额外序列扫描即可得到背景参考Z谱与主磁场偏移量.该方法不仅可替代腹部CEST成像中原有的冗杂的B0场矫正流程,同时也可分离APT效应和NOE效应的贡献.
1 材料与方法
1.1 理论和数据处理方法
在CEST成像中,频率选择性饱和脉冲导致水信号的衰减主要来源于直接饱和(Direct Saturation,DS)效应、MT效应、不同交换位点的CEST效应以及NOE效应.其中自由水池的DS效应与半固态大分子池的MT效应广泛存在于Z谱中,而CEST效应与NOE效应则仅在对应的交换点附近存在.我们将仅包含DS效应与MT效应的归一化水信号衰减随着照射频率变化的曲线称为背景参考Z谱.如果每个像素都能得到准确的背景参考Z谱,将它与扫描得到的Z谱进行相减便可以提取出不同交换位点的CEST或NOE对比度信息.
其中,
表1 仿真模型遍历的体部MRI参数信息
Table 1
| 质子池类别 | 生理参数类别 | 数值范围 |
| 自由水池 | 纵向弛豫率R1/s−1 | 0.5~1.3 |
| 自由水池 | 横向弛豫率R2/s−1 | 4~20 |
| 自由水池 | 化学位移 | δ −1.6~1.6 |
| 半固态大分子MT池 | 质子浓度分数/% | 0~8 |
| 半固态大分子MT池 | 交换率/s−1 | 19~40 |
| 半固态大分子MT池 | 纵向弛豫率R1/s−1 | 1.1~1.35 |
| 半固态大分子MT池 | 横向弛豫率R2/s−1 | 8×104~1.5×105 |
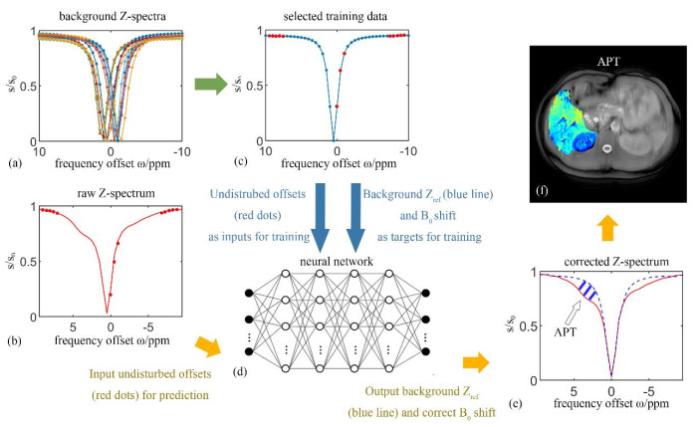
图 1为本文提出的APT成像重建方法的流程图.首先,通过数值仿真产生理想背景参考Z谱集,并进行加噪处理,以得到更接近真实情况的模拟背景参考Z谱集[图 1(a)].然后,对于每个模拟的背景参考Z谱,以频率偏移为δ −9.5、−9、−8.5、−8、−7.5、−1.5、−1、−0.5、7.5、8、8.5、9和9.5的归一化水信号作为模型训练输入[图 1(c)中红色点],这些频率偏移避开了酰胺质子(δ 3.5)、氨基质子(δ 2.0)和羟基质子(δ 1.0)的CEST效应与脂质质子(δ −2 ~ −5)的NOE效应交换点位置. 将整个背景参考Z谱[图 1(c)蓝色实线]以及自由水池化学位移偏移量作为模型的训练输出.本研究共从数值仿真中得到40万个背景参考Z谱,并随机分为三部分:28万个作为训练数据集,6万个作为验证数据集,6万个作为测试数据集.通过Matlab软件“nftool”工具包(MathWorks,Natick,MA)训练得到由10个S型隐藏神经元以及线型输出神经元组成的多层前馈式神经网络,如图 1(d)所示.本文采用了Levenberg-Marquardt算法对神经网络进行训练,该算法提升了训练效率.当模型的泛化能力不再提升时,训练过程便会停止.使用一台具有8核心处理器与6 Gb显存的计算机对神经网络训练的总时长大约是7 h,之后对新采集的数据使用网络预测每组数据的时间小于10 s.
图1
图1
数据处理流程.(a)数值仿真生成的背景参考Z谱集;(b)采集得到的任一像素的原始Z谱,其中将红色点处的数据输入网络,以得到该像素的背景参考Z谱和水峰偏移量,用于后续的Z谱矫正;(c)任一仿真背景参考Z谱,其中红色点处的数据作为模型的训练输入,完整的Z谱(蓝线)以及水峰偏移量作为模型的训练输出;(d)使用的神经网络模型;(e)蓝紫色虚线为矫正后的背景参考Z谱,红色实线为矫正后的原始Z谱,箭头所指的阴影部分为两者相减得到的APT效应的贡献;(f)生成的APT图像
Fig.1
Schematic of data processing. (a) Simulated background Z-spectra; (b) The acquired raw Z-spectrum, in which the red solid dots are inputted into the neural network to produce background reference Z-spectrum and water peak offset for correcting Z-spectrum later; (c) A simulated background Z-spectrum, in which the data marked as red solid dots are inputs for training and the complete Z-spectrum represented by blue line as well as the water peak offset are targets for training; (d) The feedforward neural network generated and applied; (e) The water peak offset and the background Z-spectrum (marked as bluish violet dashed curve) are obtained from the network and used to correct the raw Z-spectrum. The shaded part indicated by the arrow is the difference between bluish violet dashed curve and red solid curve, which is contributed from APT effect; (f) The APT map
当采集到每个射频频率偏移位置的数据点后,先通过参考扫描的图像进行归一化,再将他们进行三次样条插值后绘制成原始的Z谱[图 1(b)中红色实线],然后将δ −9.5、−9、−8.5、−8、−7.5、−1.5、−1、−0.5、7.5、8、8.5、9和9.5对应的归一化水信号数据[图 1(b)中红色点]输入到网络中进行预测,得到相应的参考背景Z谱和自由水水峰偏移量(即B0场偏移量),用以矫正原始Z谱.矫正后的结果如图 1(e)所示,红色实线表示矫正后的采集Z谱,蓝紫色虚线表示矫正后的参考背景Z谱,箭头指向的阴影区为APT效应的贡献.最后,将图 1(e)中两个Z谱在特定感兴趣的交换点相减后就可得到不同的成像对比度,将处于δ 3.5处的数据点相减可得到APT成像[图 1(f)],或在δ −3.5处即得到NOE成像.Z谱相减所用的公式如下:
其中
作为对比,也可以计算得到传统的非对称性分析
先前的研究[28]显示,反差商是一种更好的CEST对比度的表现方法,可采用(4)式计算,其中
为了比较不同分析方法对两种组织间的对比度情况,我们在两种组织内分别取一个形状大小都相同的感兴趣区域(Region of Interest,ROI),并引入对噪比(Contrast-to-Noise Ratio,CNR)进行定量分析:
其中
1.2 鸡蛋清与人体腹部实验
采集生鸡蛋中蛋清部分和四名健康志愿者腹部的Z谱,并进行后处理和分析,以验正本文提出方法的B0场矫正效果,以及分离APT效应与NOE效应贡献的能力.所有实验均在3 T MRI系统(Ingenia CX 3.0T,飞利浦医疗,荷兰)上完成.
鸡蛋清扫描时,信号采集采用32通道头部线圈,使用基于快速自旋回波(Fast Spin-Echo,FSE)[29]成像模块的CEST序列(CEST-FSE),采用频率选择性反转恢复技术抑制脂肪信号.相关成像参数为:重复时间(Repetition Time,TR)= 1 400 ms,回波时间(Echo Time,TE)= 6.8 ms,视野(Field of View,FOV)= 150×150 mm2,层厚=7 mm,单层,矩阵大小=150×150,回波链长度=31,并行成像加速因子=1.6,接收带宽为320 Hz/像素.CEST饱和模块采用双射频激发[30],射频脉冲强度为1 μT,总时长为1 s.整个扫描流程共施加32个射频频率偏移点,其相对水质子共振的频率顺序为δ −10、10、−8、8、−6、6、−5、5、−4.5、4.5、−4、4、−3.75、3.75、−3.5、3.5、−3.25、3.25、−3、3、−2.5、2.5、−2、2、−1.5、1.5、−1、1、−0.5、0.5、0,另外采集一次未施加CEST饱和脉冲的图像作为参考成像,总扫描时长约为110 s.
人体腹部实验采用32通道体线圈和CEST-FSE序列,扫描参数如下:FOV = 302×380 mm2,矩阵大小=280×352,其他扫描参数与鸡蛋清一致.数据采集在被试屏气状态下完成,要求被试每次屏气到相似的呼吸深度,每次屏气时间约为9 s,共需屏气16次.检查每次屏气采集的层面基本一致后,将所得到的图像使用仪器自带的Elastix工具进行弹性配准[31, 32].为了比较不同方法得到的B0图对CEST结果的影响,还采集双回波梯度回波(Gradient Recalled Echo,GRE)图像计算得到主磁场B0图,其扫描参数为:FOV=302×380 mm2,矩阵尺寸=280×352,TR=45 ms,TE1=4.6 ms,TE2=6.9 ms,翻转角=10˚,层面位置与CEST-FSE序列一致.
2 结果与讨论
2.1 鸡蛋清成像
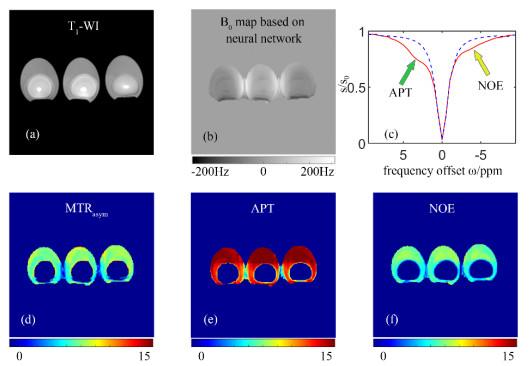
图 2显示了生鸡蛋CEST成像的结果.图 2(b)是由CEST序列采集得到的Z谱进行预测得到的B0场偏移量图.图 2(c)蓝紫色虚线显示了鸡蛋清中某个像素进行神经网络预测得到的矫正后背景参考Z谱,其水峰中心处于δ 0,说明B0场矫正得很好.图 2(d)为通过非对称性分析得到的鸡蛋清
图2
图2
鸡蛋清的CEST成像.(a) T1加权图;(b)基于神经网络预测得到的B0图;(c)鸡蛋清的矫正后Z谱(红色实线)及进行神经网络预测得到的背景参考Z谱(蓝紫色虚线),绿色与黄色箭头分别指向APT信号与NOE信号提取点;(d)非对称性分析MTRasym图;(e) APT图;(f) NOE图
Fig.2
The CEST imaging results of egg white. (a) T1 weighted image; (b) B0 map based on neural network; (c) The corrected Z-spectrum in egg white (red solid curve) and the background reference Z-spectrum (bluish violet dashed curve) obtained by neural network prediction, where the green arrow and yellow arrow indicate the positions of APT and NOE exchange, respectively; (d) MTRasym map of egg white; (e) APT map; (f) NOE map
2.2 人体腹部CEST成像
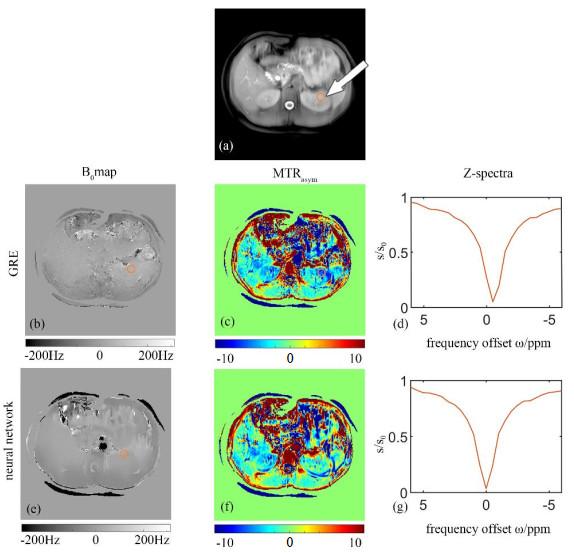
四名健康志愿者的腹部CEST成像得到了类似的效果.图 3显示了一名健康志愿者腹部由GRE序列采集和基于神经网络拟合得到的主磁场图和相应的CEST结果.两种方法得到的B0场图在大范围内基本类似[图 3(b)和3(e)].基于梯度回波的B0场图在某些小范围内出现了缠绕现象,从而导致主磁场偏移量被低估[图 3(b)],需要后续对其进行解缠绕.相比之下,基于神经网络预测所得的B0场更为平滑[图 3(e)],符合主磁场偏移的真实情况,但是皮下脂肪和大血管处Z谱受到过多干扰超出了网络的预测能力,因此在B0场图显示异常的低信号.图 3(c)和3(f)显示了通过不同主磁场矫正方法的
图3
图3
双回波梯度回波(GRE)序列采集(第二行)和基于神经网络拟合(第三行)得到的一名健康志愿者腹部主磁场B0图和对应CEST非对称分析结果.(a)未施加CEST饱和脉冲得到的参考模图;(b)~(d)双回波GRE序列得到的主磁场B0图、B0图矫正后的MTRasym图,以及对应于图(a)橙色圆环中组织的Z谱分析;(e)~(g)通过神经网络预测得到水质子共振频率偏移量生成的主磁场B0图、以此B0图矫正后的MTRasym图,以及对应于图(a)橙色圆环中组织的Z谱分析
Fig.3
Abdominal B0 maps and the corresponding CEST results of a healthy volunteer obtained by gradient recalled echo (GRE) sequence (the 2nd row) and neural network based method (the 3rd row). (a) The reference image while the CEST saturation radio frequency pulse was not applied; (b) & (e) B0 maps obtained by GRE sequence and neural network fitting, respectively; (c) & (f) MTRasym maps based on GRE sequence and neural network fitting, respectively; (d) & (g) The Z-spectrum analysis of tissue located in the orange circle in the left kidney based on GRE sequence and neural network fitting, respectively
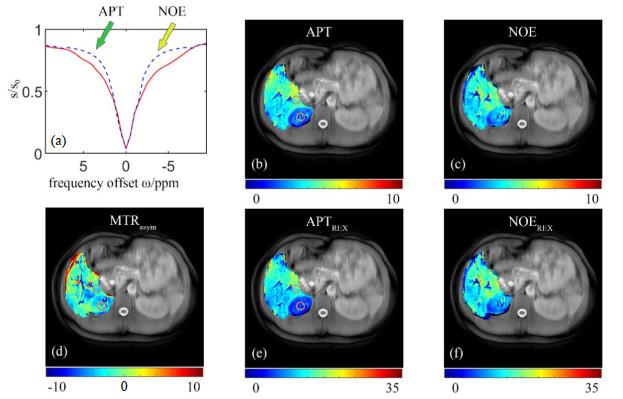
图 4显示了一名健康志愿者肝脏及右肾的基于神经网络拟合得到的CEST成像结果,其中图 4(a)展示了矫正后单个体素的Z谱(红色实线)与神经网络预测得到的背景参考Z谱(蓝紫色虚线),分别提取δ 3.5处(绿色箭头所示)和δ −3.5处(黄色箭头所示)的信号即可得到APT图[图 4(b)]与NOE图[图 4(c) ]、以及对应的反差商成像[图 4(e)&(f)].对CEST结果图上的肝脏组织与肾脏组织分别取两个ROI(图中橙色圆环)进行CNR定量分析,“APT-NOE”加权
图4
图4
基于神经网络预测方法得到的CEST不同成像对比度.(a)矫正后Z谱(红色实线)及进行神经网络预测得到的背景参考Z谱(蓝紫色虚线),绿色与黄色箭头分别指向APT信号与NOE信号提取点;(b) APT图;(c) NOE图;(d) MTRasym图;(e) APT反差商图;(f) NOE反差商图
Fig.4
The CEST results of a healthy volunteer obtained by the method based on neural network. (a) The corrected Z-spectrum (red solid curve) and background reference Z-spectrum (bluish violet dashed line), where the green arrow and yellow arrow indicate the positions APT and NOE, respectively; (b) APT map; (c) NOE map; (d) MTRasym map; (e) APTREX map; (f) NOEREX map
2.3 讨论
蛋白质分子无处不在,CEST技术可以为我们提示组织很多生理和病理信息,腹部APT成像也是如此.本研究提出了一种通过机器学习矫正主磁场偏移量并分离APT效应及NOE效应的CEST后处理方法.鸡蛋清和健康志愿者腹部成像结果显示,本文基于神经网络的CEST后处理方法取得了较好的效果.
精确测量每个像素的主磁场偏差从而生成B0图并用作矫正由主磁场不均匀性而引起的成像伪影,是腹部APT成像中关键的一步.基于GRE的相位图,可得到不同像素的磁场偏移量信息[17].然而由于腹部主磁场的不均匀性较大,因此会在某些位置中出现相位缠绕的现象,由于腹部组织的复杂性,通过相位解缠绕来稳定地还原出真实的B0值步骤仍较为繁琐[18].另一方面,额外的梯度回波序列会带来“场漂移”现象[19],这个现象在获取B0场的WASSR法中也有出现,场漂移可能是由于温度等环境因素随着时间的变化而导致的,也可能与机器本身的匀场机制有关.本文提出的基于神经网络预测的方法可得到比较精确的主磁场B0图,可有效矫正腹部CEST成像中主磁场不均匀性的影响.虽然基于神经网络的Z谱在皮下脂肪与大血管处受到较大干扰,超出了网络预测范围,但不会影响感兴趣的组织信息,效果上是可以接受的.此外,因此本文所提出的B0场矫正方法不需要额外的扫描序列,在达到稳定校正效果的同时还节省扫描时间.
目前临床APT成像中广泛采用非对称性分析的方法来提取酰胺基团交换点位置的信号.虽然这个方法可以去除MT与DS效应的影响,但这仍然面临着在Z谱δ −3.5处的信号不纯净的问题.因此从CEST临床应用的角度,单独提取Z谱两侧的信号或许更有价值.本文分析了组织潜在可能的背景参考Z谱的表现模式,通过神经网络进行学习并预测每个像素采集Z谱的背景参考谱线形,并由此得到纯净的APT对比度与NOE对比度.鸡蛋清和健康志愿者腹部成像结果均显示,与基于非对称性分析方法得到的APT-NOE加权图相比,纯APT图具有更好的组织对比度,这有可能让腹部病变的诊断更加敏感.
在体部CEST成像中,δ −3.5处信号降低的贡献不仅有NOE效应,同时也有部分的脂肪DS效应,而目前的脂肪抑制方法都不能稳定地去除所有脂肪的影响,而且不同的脂肪抑制方法和主磁场均匀性会到导致抑脂效果不一样,因此采用非对称性分析方法研究个体之间的CEST效应差异会出现很大问题.本文方法能将δ 3.5处APT效应的贡献单独提取出来,理论上可不受脂肪抑制效果的影响,对个体中、个体间及组间的定量分析有着积极作用.
我们的研究也还有一些值得进一步改进的地方.首先,不同的射频照射时长及强度都会改变DS效应和MT效应,因此每个特定的CEST饱和射频策略都需要训练一个独特的网络,如果改变序列的CEST饱和策略则需要重新训练神经网络.其次,对于主磁场偏移量的预测有一定的范围限制,偏移量超过200 Hz时可能会超出预测的范围,这与表 1中自由水池偏移量设定较为保守有关.此外,网络模型有一定的改进空间,将来或许可以通过采集更少的点来进行预测分析.最后,对于其他器官,需要对所在器官组织的生理参数范围做出相应的适配后才能应用.
3 结论
本研究提出了一种应用于腹部APT成像的后处理方法,利用神经网络拟合背景参考Z谱,同时获得自由水池水峰偏移量的信息进行矫正并提取信号,成功地获得了纯净的APT对比度的信息,对科学定量CEST研究起到积极作用.
参考文献
Study of moderately rapid chemical exchange reactions by means of nuclear magnetic double resonance
[J].DOI:10.1063/1.1734121 [本文引用: 1]
Evaluating pH in the extracellular tumor microenvironment using CEST MRI and other imaging methods
[J].
pH Imaging based on chemical exchange saturation transfer: Principles, methods, applications and recent progresses
[J].
基于CEST机制的pH成像方法、原理和应用
[J].
Using the amide proton signals of intracellular proteins and peptides to detect pH effects in MRI
[J].
Factors affecting chemical exchange saturation transfer imaging on 1.5 T clinical MRI scanners
[J].
1.5 T磁共振化学交换饱和转移成像的影响因素分析
[J].
Practical data acquisition method for human brain tumor amide proton transfer (APT) imaging
[J].DOI:10.1002/mrm.21712 [本文引用: 1]
Comparisons of different CEST quantification metrics applied in acute parkinson's disease mouse model
[J].
CEST成像不同量化方式在急性帕金森氏病小鼠模型研究中的应用比较
[J].
Improved differentiation of low-grade and high-grade gliomas and detection of tumor proliferation using APT contrast fitted from Z-spectrum
[J].DOI:10.1007/s11307-017-1154-y [本文引用: 1]
CEST signal at 2 ppm (CEST@2 ppm) from Z-spectral fitting correlates with creatine distribution in brain tumor
[J].
Clinical applications of chemical exchange saturation transfer (CEST) MRI
[J].DOI:10.1002/jmri.25838 [本文引用: 1]
APT-weighted MRI: Techniques, current neuro applications, and challenging issues
[J].DOI:10.1002/jmri.26645 [本文引用: 1]
Liver MRI with amide proton transfer imaging: feasibility and accuracy for the characterization of focal liver lesions
[J].DOI:10.1007/s00330-020-07122-y [本文引用: 2]
Chemical exchange saturation transfer (CEST) MR technique for in-vivo liver imaging at 3.0 tesla
[J].
Amide proton transfer-weighted MRI for predicting histological grade of hepatocellular carcinoma: comparison with diffusion-weighted imaging
[J].DOI:10.21037/qims.2019.08.07 [本文引用: 1]
Algorithms for extracting motion information from navigator echoes
[J].DOI:10.1002/mrm.1910360120 [本文引用: 1]
Water saturation shift referencing (WASSR) for chemical exchange saturation transfer (CEST) experiments
[J].DOI:10.1002/mrm.21873 [本文引用: 1]
Correction for artifacts induced by B0 and B1 field inhomogeneities in pH-sensitive chemical exchange saturation transfer (CEST) Imaging
[J].DOI:10.1002/mrm.21398 [本文引用: 2]
Integrated Laplacian-based phase unwrapping and background phase removal for quantitative susceptibility mapping
[J].DOI:10.1002/nbm.3056 [本文引用: 2]
Quantitative magnetic susceptibility mapping without phase unwrapping using WASSR
[J].DOI:10.1016/j.neuroimage.2013.09.072 [本文引用: 2]
Editing of chemical exchange-relayed NOEs in NMR experiments for the observation of protein-water interactions
[J].DOI:10.1006/jmre.1998.1646 [本文引用: 1]
MR imaging of the amide-proton transfer effect and the pH-insensitive nuclear overhauser effect at 9.4 T
[J].DOI:10.1002/mrm.24315 [本文引用: 1]
Quantitative separation of CEST effect from magnetization transfer and spillover effects by Lorentzian-line-fit analysis of Z-spectra
[J].DOI:10.1016/j.jmr.2011.05.001 [本文引用: 1]
A model for magnetization transfer in tissues
[J].DOI:10.1002/mrm.1910330404 [本文引用: 1]
Chemical exchange saturation transfer MRI contrast in the human brain at 9.4 T
[J].DOI:10.1016/j.neuroimage.2018.06.026 [本文引用: 1]
Quantitative interpretation of magnetization transfer
[J].DOI:10.1002/mrm.1910290607 [本文引用: 1]
Numerical solution of the Bloch equations provides insights into the optimum design of PARACEST agents for MRI
[J].DOI:10.1002/mrm.20408 [本文引用: 1]
A combined analytical solution for chemical exchange saturation transfer and semi-solid magnetization transfer
[J].DOI:10.1002/nbm.3237 [本文引用: 1]
Relaxation-compensated CEST-MRI of the human brain at 7 T: Unbiased insight into NOE and amide signal changes in human glioblastoma
[J].DOI:10.1016/j.neuroimage.2015.02.040 [本文引用: 1]
Amide proton transfer imaging of brain tumors using a self-corrected 3D fast spin-echo Dixon method: Comparison with separate B0 correction
[J].DOI:10.1002/mrm.26322 [本文引用: 1]
Analysis protocol for the quantification of renal pH using chemical exchange saturation transfer (CEST) MRI
[J].
elastix: A toolbox for intensity-based medical image registration
[J].DOI:10.1109/TMI.2009.2035616 [本文引用: 1]
Fast parallel image registration on CPU and GPU for diagnostic classification of Alzheimer's disease
[J].